1.はじめに
筋肉は動物に運動を与える器官として進化してきた.脊椎動物において,素早い収縮を実現する骨格筋,心臓の鼓動を起こす心筋,そして内臓などにみられる平滑筋などが存在し,それらはいずれも,生命活動に必須な器官,組織である.分子細胞生物学分野の急速な発展に伴い,筋収縮の仕組みをタンパク質の特性から明らかにすることが試みられている.タンパク質のナノメートルスケール#から筋肉を眺めると,それは化学エネルギーを力学的なエネルギーに直接変換する分子機械であり,揺動の激しい熱浴中で秩序をもって物質を輸送するトラックでもある.実際に,筋肉から抽出されたタンパク質を人工的に組み合わせることで,その運動を純粋に分子のレベルで再現し,顕微鏡下で定量評価できる.微小な運動系を再構成することで筋収縮の分子機構に迫る.
2.筋収縮モデル
20世紀の初頭,骨格筋は,高エネルギー化合物であるアデノシン3リン酸(ATP)の分解によって収縮することがわかっていたが,その構造は不明であった.収縮の機構に関して2つのモデルが考えらていた.ひとつは,ゴムのようにそれ自体が伸縮をするというモデルであった.ある電解性高分子ゲルが,カルシウムイオンの付加や水素イオン濃度変化などによって収縮することが知られていたからである.その一方で,タンパク質繊維の複合体が何かしらの構造変化をするというモデルがあった.現在では,後者であることがわかっているが,その発端は,1950年代におけるケンブリッジ大学のハクスレらによる電子顕微鏡を用いた筋繊維の構造解析であった.
筋肉は直径およそ50マイクロメートル,長さおよそ1センチメートルの円筒状の細長い細胞(筋繊維)の集合体で,その細胞膜内に数千本の筋原線維を含んでいる.さらにそれはサルコメアと呼ばれる収縮の最小単位から構成されている.サルコメア内には細い繊維そして太い繊維を呼ばれる構造体があり,それぞれタンパク質であるアクチンとミオシンから構成されている.そして,これら繊維は互い違いに重なり合うように束になっており,太い繊維から突起物(クロスブリッジ)が細い繊維に向かって多数伸びている.収縮時には繊維自体が縮むことなしに,2つの繊維が滑り込む(滑り説).
3.化学力学エネルギー変換 生体内で利用されるエネルギーは多くの場合,化学反応によるものである.主に,高エネルギー化合物としてアデノシン3リン酸(ATP)が生体反応の基質として幅広く利用される.アデノシン3リン酸は,自発的にアデノシン2リン酸(ADP)とリン酸(Pi)に加水分解されため,それ自体はエネルギーの高い状態である.そのためATPからADPへとエネルギーが低い状態に落ちる際に,およそ1モルあたり32キロジュールの利用可能なエネルギーを放出する(うまく利用しなければ熱となる).この値をひとつのATP分子に換算すると,およそ54×10–21ジュールで,熱エネルギーの数倍程度の大きさでしかない.我々が利用する内燃機関は,ガソリンの化学エネルギーを熱エネルギーに変えてから,仕事に変換するため効率に限界がある.そしてガソリン1分子を力仕事に変換することはできない.ところが,生体分子は,化学エネルギーを仕事に変換した後,熱として捨てる.そしてその変換は1分子でも可能である. 4.ミオシンとアクチン:分子モーターと細胞骨格 化学力学エネルギー変換によって運動するタンパク質を分子モーターと呼んでいる.以前には,運動機能は,筋肉中のタンパク質であるミオシン分子に特有なものであると考えられきたが,1980年代以降,ミオシン以外にも構造が類似した運動機能をもつタンパク質(キネシン,ダイニン)が幾つか発見された.そして,それらは細胞のいたるところに存在し,細胞内輸送や細胞分裂に必須であることが明らかにされた.加えて,ミオシンでさえも筋肉に特有なものではなく,植物にも存在する広く分布する多様性のある分子モーターであることがわかってきた.
骨格筋のミオシン分子(約4000個のアミノ酸から成る)は,2つの大きななす形の部分(頭部)とその2つを束ねる長い棒状の部分から構成されている.この頭部はATPを加水分解する酵素機能をもち,この反応の過程において,なす型の構造が変形して折れ曲がる.この変形がアクチン線維に伝達されることが滑り運動の仕組みであるとのモデルが現在では支持されている.この機械論的モデルは明快であるため受け入れやすいが,歯車の如き動作には疑問をもつ研究者も多い.棒状の部分は,ミオシンの種類により多様性がみられ,自己会合したり,輸送体と結合したりするなどの働きをもつ. 一方,細胞骨格は真核細胞の形を保つため,また動的な変化を与えるための骨組みとして,そして物質輸送のハイウェイとしての働きをもつ.細胞骨格は主に三種類ほど認められ,アクチン線維,微小管,中間径フィラメントと呼ばれる.アクチン線維は,細胞中に豊富で普遍的なタンパク質であると共に,筋肉の主成分として収縮に関与する点においても重要である.アクチン線維は球状のアクチン分子(アミノ酸が約380個繋がったタンパク質)が2重らせん状に重合した直径8ナノメートル,長さ数マイクロメートルの繊維状の構造体である.この構造は静的で硬いものではなく,ときには分子が結合または解離することで伸張するような動的で柔軟な性質を示す.
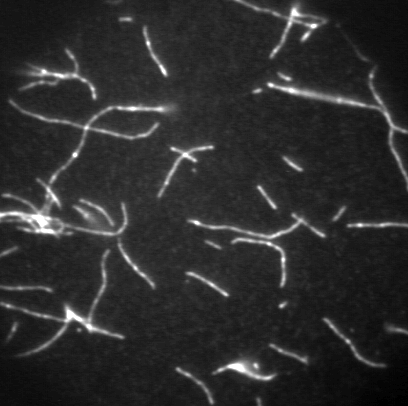
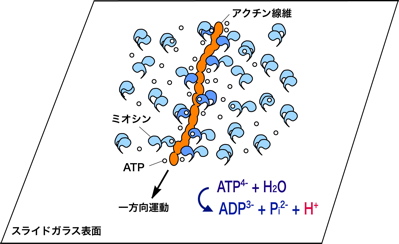
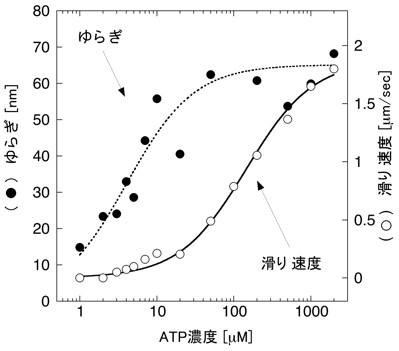
5.熱運動とゆらぎ タンパク質分子は,一般的に数ナノメートルの大きさをもち,それは量子力学またはニュートン力学を適用するには中途半端な大きさでもある.タンパク質は大抵,水の中で,常温で働くため,熱揺動を強く受けることになる.その構造と機能は,水との馴染みやすさや分子の熱揺動に支配される.実際に,ピコ秒の範囲で5 m/sの速度をもつ.本来,化学反応はフェムト秒で進行するが,ミオシンのようなATP分解酵素はミリ秒のきわめてゆっくりとした時間スケールでATPを分解させる.この酵素反応は速く不規則な熱揺動を遅く秩序ある運動に変調することになる. 6.人工的な運動系再構成 1970年代まで,光学顕微鏡は主に細胞の構造を知る目的で使用されていた.多くの場合,染色液で処理することで核を染めるか,大量の蛍光抗体を使ってタンパク質を染めることにより固定された細胞全体の観察にとどまっていた.なぜなら可視光の波長より小さなタンパク質を光学顕微鏡で観察することは不可能のように思われていたからである.ところが1980年代に名古屋大学の朝倉らによって蛍光顕微鏡下において1本のアクチン線維の観察が可能であることが実証された.彼らは,アクチン分子に蛍光色素であるフルオレセイン(青い光を当てると黄色い光を発する)を直接結合させた後,その分子が重合したアクチン線維を水溶液中でリアルタイムに蛍光観察した.その結果,アクチン線維が熱揺動し,柔軟な構造体であることを示した.図6はアクチン線維を撮影した例である.これまで電子顕微鏡を用いた方法がタンパク質の観察の唯一の方法であったことを考えると,生で動く様子を映した像は,画期的であった.これ以降,光学顕微鏡法は著しく改良・発展し,現在ではタンパク質の運動や結合を1分子レベルで観察することも可能になっている.このようなバイオイメージング技術は生命現象の解明にむけて盛ん応用され続けている. 図6:蛍光顕微鏡下で観察されたアクチン線維 タンパク質の可視化によって,タンパク質間の結合や解離そして相互作用を直接に知ることができる.そのひとつ例は,筋肉タンパク質による滑り運動の測定であった.ミオシン分子を適切な条件下でスライドガラス表面上に固定した後,蛍光染色されたアクチン線維を加えると,その線維がミオシン分子と結合する様子を観察できる.さらにそこへアデノシン3リン酸を加えることで,アクチン線維がその長軸方向に滑り出す(図7).これは筋肉という複雑な組織をもたない,純粋な分子による運動系を再構成したことになる.この滑り運動は,ミオシン分子やATPなしで無秩序に熱揺動するアクチン線維とは全く異なり,一定の速度で滑らかに一方向に実現される.実に,1秒間に5マイクロメートルの速度で運動し,この速度は生きた筋肉の最大収縮速度に一致する.もし何も告げられずに,この映像を見たならば,きっと線虫や微生物と思うことだろう.つまり,このようなタンパク質でさえ,自律的に動きを制御していることを想像させる.しかも,絶えず熱揺動を受けているにもかかわらずである.そこにマクロな機械との違いの秘密が隠されているように思える. 図7:滑り運動系再構成 7.アクチン線維の運動解析 アクチン線維の滑り運動を直接評価できるようになったが,それだけに留まらない.例えば,アクチン線維やミオシン分子を直接にマイクロニードルで操作したり,光を利用したピンセットによって分子に外力を加えることもできる.様々な実験方法や研究グループによって,ミオシン1分子が発生する張力や変位が測定されている.これらの値は研究グループによって開きがあるため,完全には決定されていない.けれども多数意見としてミオシン分子がATP1分子を分解する過程において,変位が5〜10ナノメートル,最大張力が5ピコニュートンで動作することが妥当とされている.もっとも単純な仮定で,この変位と力の積をとると,50×10–21ジュールである.この値はひとつのATP分子から利用可能なエネルギー量に近いものである. 光学顕微鏡像は,他の分光学的方法に比べて空間的情報に富むことから,アクチン線維のような超分子構造体の時間空間での変化を知るために有効である.さらにナノメートルスケールで運動を検出することが,タンパク質運動を説明するうえで必要となる.しかし,光の回折の性質により0.5マイクロメートルより小さいものを区別することはできない.私はこの問題を克服するために,画像の光強度分布の定量をおこなうことで,像の中心位置を決定する方法を考案した.つまり,物体の位置情報ならば,回折限界によらず,ナノメートルの変位を測定することができた.アクチン線維の長軸に沿って広い範囲の運動を調べた結果,一方向の運動を実現するためには,線維上にゆらぎの発生が重要であることがわかった(図8).そしてゆらぎは線維にわたって協調的に発生しており,タンパク質分子間でのコミュニケーションの存在を予感させた.つまり,タンパク質という物質レベルで生物らしさの要素が備わっているのかもしれない. 図8:ゆらぎと滑り速度 8.展望 ナノメートルの分子測定法の確立により,様々なタンパク質分子あるいはDNA分子を化学的な特性だけでなく,物理的な特性からも評価できるようになった.これら分子の生体内での活動を予測することができるようになるだろう.さらに生体の分子機械の仕組みを解き明かし,模倣することで微小領域のモーターとしての利用が期待される. 参考文献 大沢文夫,講座:生物物理,丸善,1998. 山本啓一,丸山耕作,筋肉,化学同人,1986. Howard, J., Mechanics
of Motor Proteins and the Cytoskeleton, Sinauer Associates, 2001. Bray, D., Cell
Movements, Garland Publishing, 2001.