1. 超解像顕微鏡法 dSTORM
超解像顕微鏡法のひとつであるdSTORM(direct Stochastic Optical Reconstruction Microscopy;直接確率的光学再構築顕微鏡法)を試みる.チオール還元剤存在下および低溶存酸素濃度条件において特定の蛍光色素が強いレーザー光によって励起されたとき,多くの色素が暗状態なる中で確率的にまれに蛍光を発する色素分子が生じる.時間空間的に確率的に色素分子が点滅する.各蛍光点画像(輝度分布)をガウス関数でフィッティングすることで蛍光点の中心位置をナノメートル精度で決定できる.時系列の多数の画像における蛍光点の正確な位置を重ねてプロットすることで,分解能 40 nm程度の画像を構築する.
図1.dSTORM化Nikon TMD-Diaphot
2. アクチンの蛍光標識
ここでは dSTORMに適したAlexa系の色素であるAZDye532-NHS(Fluoroprobes社)をアクチンのアミノ基に共有結合させてアクチンを標識した.AZDye532-NHSをモル比でアクチンの6倍量をアクチン線維に加えて反応させた後,超遠心分離とゲルろ過によって未結合の余分な色素を除いた.最終的にアクチン:AZDye532の結合比は1:1程度であった.標識アクチンを適切な溶液下で重合させ,ファロイジンを添加して安定化させた.3. 高出力レーザーの導入
励起用レーザーには,Civil Laser社, 532 nm/800 mW, マルチモード,105 µm/NA 0.22ファイバー結合を用いた.ファイバー出口でコリメーターレンズ f=7.86 mmを取付け,ビーム径を3.6 mmとし,そこから f=15 mmと f=30 mmの凸レンズを組み合わせてビーム径を倍にした.これらレンズ間の集光点にスペックルリデューサー(LSR-3005-17S-VI, optotune社)を配置して,マルチモードレーザーによる干渉模様を緩和させた.ビーム径7.2 mmの入射光は顕微鏡 f=160 mmのレンズを介して対物レンズの後焦点で集光させ,試料に70 µmの範囲で照明された.レーザーファイバー出口の出力 500 mWのとき,試料面において2.9 kW/cm2のパワー密度が得られた.
図2.Thorlabs社ケージシステムを使ったレーザー導入系とNDフィルターのサーボモータ駆動
4. 蛍光フィルター
顕微鏡蛍光用フィルターをAZDye532に合わせてエドモンドオプティクス社のフィルターに変更した.励起フィルター用 TS枠なし蛍光用BPフィルター 534nm x 20nm 12.5mm #18-373,分光用 蛍光用ダイクロイックプレート型B/S 552nm 12.5 x 17.6,#86-320,バリヤー用 蛍光用バンドパスフィルター 591.5nm x 43nm 径12.5 mm,#67-020をNikon旧蛍光キューブに取付けるために3Dプリンターでアダプターを作製した.
図3.油浸100倍対物レンズ(NA 1.4)と蛍光フィルターキューブ
5. カバーガラスの洗浄と処理
dSTORM条件でのレーザー光の照射では,新品のカバーガラスであってもそれ自体で蛍光の輝点が生じた.そのためカバーガラスを予め洗浄した.カバーガラス(24 x 50 mm, Neo, matsunami)を10倍希釈のSCAT20-X(洗浄液)で50℃,30分の超音波洗浄後,純水で十分にすすぎ,アルゴンガスで水を飛ばしたものをクリーンベンチで乾燥させた.そこへ,0.2%コロジオン溶液を塗布して2日間乾燥によりコロジオンでコートした.PDMS製の枠(18x18mm,幅3 mm,厚み1 mm)をカバーガラスのコロジオンコート面の中央に設置した.
図4.カバーガラス上のPDMS枠
6. アクチン線維の観察試料調製
ミオシン(およびHMMやS1)はコロジオンコート上に自発的に結合しスライド表面に固定される.ATP非存在下でアクチン線維はミオシン頭部と強く結合する.この性質によりアクチン線維をS1を介してスライド表面に固定した.さらに観察中でのタンパク質ペプチド鎖間の分離を防ぐためにグルタルアルデヒドによりペプチド鎖間を化学架橋した.コロジオンコート面にミオシン頭部(S1)溶液を加えて1分待った.S1溶液を取り除き,標準Buffer(25 mM KCl, 25 mM HEPES (pH 7.4), 4 mM MgCl2)で十分にリンスした.蛍光標識アクチン線維(1 µg/mL,10 µL)を加えて,よくリンスした.固定液(標準Buffer+1%グルタルアルデヒド)を加えて10分待った.よくリンスした後に,還元剤を含んだ観察液(標準Buffer+0.1 M システアミン)を満たし,小さなカバーガラス(18 x 18 mm)で覆った.観察液を事前に真空機で脱気し,溶存酸素濃度を低くした.
7. 撮影
レーザーファイバー取付のコリメータ出口にNDフィルター(OD 1.5)を設置した.このフィルターをサーボモータにより移動させることで,NDの挿入,開放を切り替えた.サーボモータはArduinoにより制御させた.レーザー出力500 mWでNDフィルター挿入から撮影した.撮影のためのカメラにはDMK33UX287(The imaging source社)を用いた.露光時間は1/30秒で最大ゲイン47dBのうち35dBで撮影が可能であった.撮影範囲を256×256ピクセルとした.このとき1ピクセルは0.087 µmに相当する.モノクロ階調Y800(8 bits)またはY16(16 bits)で画像取得できるが,今回はY800とした.従来の蛍光像を撮影後,NDフィルターを開放にし,dSTORMを開始させた.6000フレームを取得した(3.3分).連続画像を無圧縮AVIファイルとして保存した.図5.dSTORM開始前とNDフィルター開放後の蛍光点滅
Visual C# により画像取得アプリを作成した.カメラの撮影に合わせてシリアル通信によりNDフィルターをサーボモータにより動作させた.通常の蛍光像を取得後,dSTORM条件で撮影しAVIファイルに保存する仕様とした.
図6.動画像取得アプリのインターフェイス
8. 超解像再構成
連続画像をImageJで開き,ThunderSTORMプラグイン(Martin Ovesný et al, Bioinformatics 30, 2389–2390, 2014)により超解像を再構築した.元画像の縦横8倍のピクセル数で画像を構築した.ドリフト補正もできる.再構成画像の輝度値は空間での点滅数の確率密度に相当する.アクチン線維像の線維横方向の密度分布から半値幅(FWHM = 2.35 ✕ 分布標準偏差)を求めた.最大値43 nm,最小値27 nm,平均値37 nmを得た.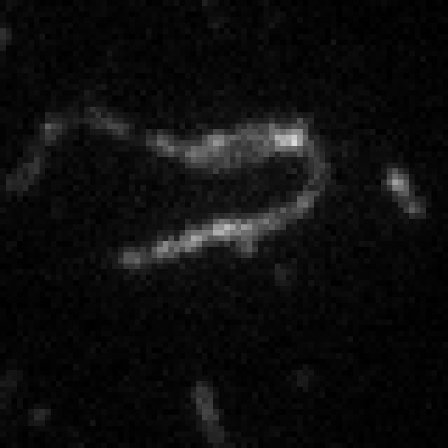
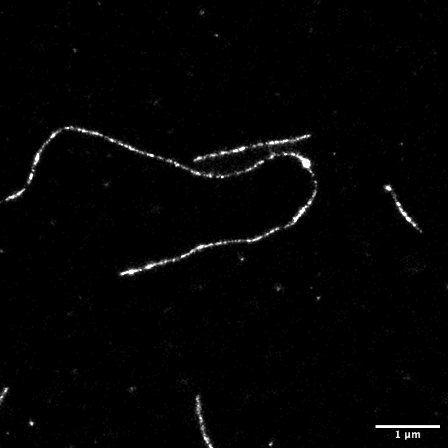
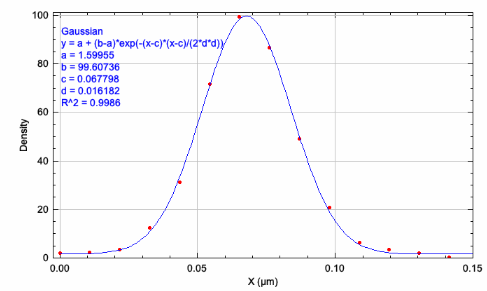
図7.dSTORM開始前の画像(左)とdSTORMによる再構成画像(右) dSTORM画像の線維横方向の幅(下)
(研究方法へ戻る)