1. 物質の蛍光
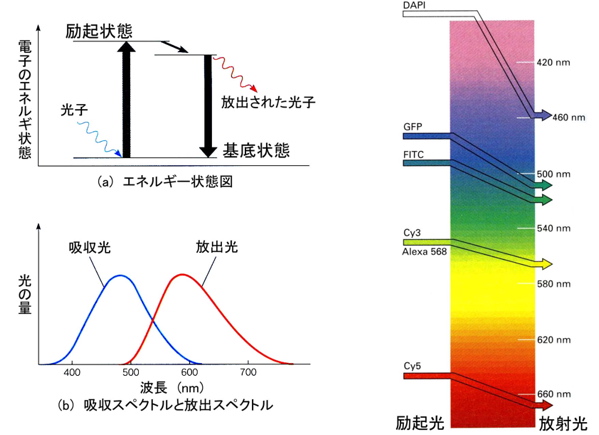
ある物質が特定の波長の光を吸収して,それより長波長の光を放射する現象を蛍光と呼びます.このような蛍光を発する物質(分子)は様々な種類のものが天然に存在したり,合成されたりしています.蛍光分子はその物質に特有な波長の光の吸収によって,基底状態にあった電子がエネルギの高い励起状態にフェムト秒で遷移します.そしておよそピコ秒後,分子内緩和(分子内振動を経て熱へ)が起こり一段低い励起状態に遷移します.さらにナノ秒後,電子が基底状態に戻るとき発光します(蛍光).蛍光分子は紫外光から赤外光にいたるまで様々な種類があり,用途に応じて選択されます.主に分子運動のプローブとして用いられ,標的となる高分子の濃度,結合解離,構造変化,配向,反応速度,揺動の速さなどの情報を得ることができます.フェムト秒やピコ秒のパルス光による分光法では,分子揺動のような非常に速い運動を測定できます.定常光による分光法では,濃度や分子間相互作用など測定ができます.それとは別に顕微鏡法において,高分子のイメージングの手段として蛍光分子が利用されています.
2. 蛍光標識
標識を目的とした様々な蛍光分子が製造されています.標的となる分子やその測定に応じて蛍光分子を選択します.この蛍光分子は蛍光と発する部分と標的に反応する官能基から構成されます.選択基準として,励起波長,蛍光波長,親水性,疎水性,大きさ,官能基などを考慮します.例えば,タンパク質を蛍光標識する場合にはそのリシン側鎖にあるアミノ基,またはシステイン側鎖のチオールに反応する官能基を有する蛍光分子が用いられます.アミノ基に反応し共有結合を形成するものとしてNCS基(isothiocyanate)やNHS基(N- Hydroxy succinimide ester)などがあります.また,チオール基に反応するものとしてマレイミド基(maleimide)があります.このような官能基によってタンパク質の側鎖に蛍光分子を直接に共有結合させることができます.蛍光イメージングでの利用には可視光領域の蛍光をもつものが適しています.例えば,フルオレセイン(fluorescein)は黄緑色,ローダミン(rhodamine)はオレンジ色の蛍光をもちます.
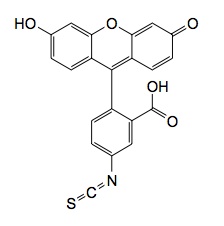
FITC (Fluorescein isothiocyanate):分子量389.38,励起波長 494 nm,蛍光波長 520 nm,1級アミノ基に反応

TRITC (Tetramethylrhodamine isothiocyanate):分子量478.97,励起波長 541 nm,蛍光波長 572 nm,1級アミノ基に反応
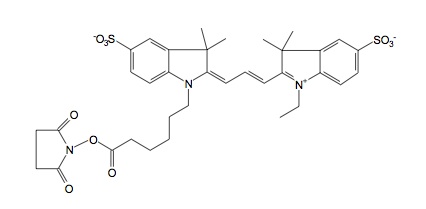
Cy3-NHS (Cy3 N- Hydroxy succinimide ester):分子量765.95,励起波長 550 nm,蛍光波長 570 nm,1級アミノ基に反応
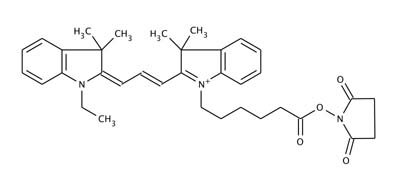
IC3-OSu (N-Ethyl-N'-[5-( N''-succinimidyloxycarbonyl)pentyl]indocarbocyanine):分子量604.18,励起波長 550 nm,蛍光波長 570 nm,1級アミノ基に反応
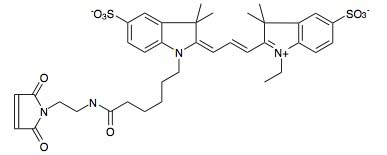
Cy3-maleimide:励起波長 550 nm,蛍光波長 570 nm,SH基に反応
蛍光分子をタンパク質に直接的に結合させる方法だけでなく抗体などを用いて間接的に結合させる方法も使われます.標的となるタンパク質に対する抗体を蛍光分子で予め標識した後,そのタンパク質と標識抗体を混合することで抗体抗原反応によって選択的にタンパク質を検出することができます.しかしながら,抗体の結合は標的タンパク質の性質を著しく損なうため注意が必要です.その他,抗体以外に特定のタンパク質に強く結合するペプチドが存在する場合があります.例えば,細胞骨格のアクチン線維には,ファロイジンと呼ばれる毒キノコ由来のペプチドが選択的に強く結合することが知られています.このファロイジンを蛍光標識したものをアクチン線維と混合することで性質を著しく変えることなくアクチン線維を均一に蛍光染色することができます.
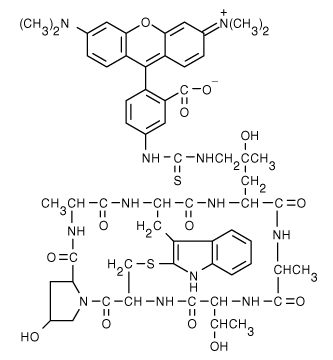 TRITC-labeled phalloidin (Rhodamine-phalloidin)
TRITC-labeled phalloidin (Rhodamine-phalloidin)
3. 蛍光の分光
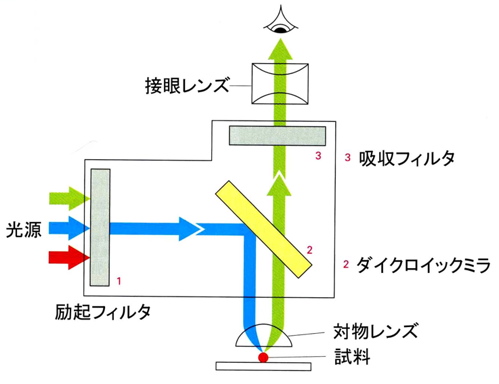
蛍光分子によって標識された高分子を蛍光顕微鏡下で観察することができます.そのためには励起光とそれによって発光した蛍光のそれぞれの光を分離しなければなりません.一般的に光源として水銀ランプやキセノンランプを用います(レーザー光も有効).その幅広いスペクトルをもつ光から励起光となる波長の光だけを透過する干渉フィルターを使って励起光を選択します.励起光はダイクロイックミラーと呼ばれるミラーで反射され蛍光試料に照射されます.このダイクロイックミラーは特定の波長以下の光を反射し,それより長波長の光を透過するミラーです.励起された蛍光試料から放射された蛍光はダイクロイックミラーを透過した後,吸収フィルターで余分な波長の光がカットされます.このような経路で得られた光を最終的に検出します.フィルターやミラーは使用する蛍光分子の特性に合わせて選択する必要があります.さらに,それらは特定の波長のみを完全に透過,反射,吸収するのではなく,ある程度波長幅をもっていることからそれぞれのフィルターやミラーの波長帯を適切に組み合わせないとよい映像は得られません.レーザーを光源に用いた場合にはその性質から単色光であるので,フィルター類の選択は容易かもしれません.
4. 蛍光イメージング
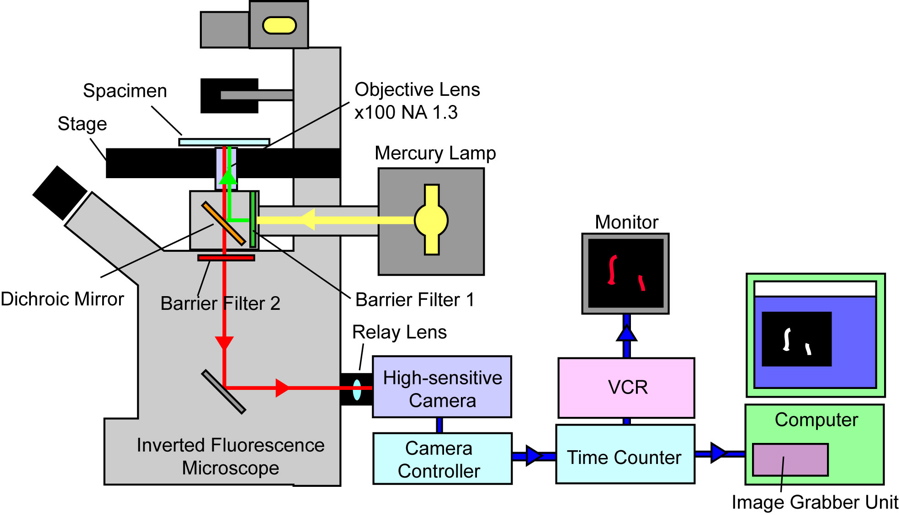
透過光を用いた顕微鏡では,十分な照明光が試料を透過するときに光が吸収されるか減衰することで像を得るのに対して,蛍光顕微鏡では光のないところで試料からの発光によって像を得るものです.この点,透過光を用いた観察と蛍光を用いた観察とは原理が大きく異なり,その利用方法や利点も注意する必要があります.蛍光観察のためには蛍光照明用のユニットを装備した専用の顕微鏡を使用します.下図では倒立型蛍光顕微鏡(Inverted Fluorescence Microscope)を示しています.水銀ランプ(Mercury Lamp)からの光は励起フィルター(Barrier Filter1)で励起光だけ選択され,ダイクロイックミラー(dichroic Mirror)を介して反射された後,対物レンズ(Objective Lens)を通して試料(Spacimen)に照射されます.対物レンズはなるべく開口数(NA)の大きな明るいレンズを使用します.試料中の蛍光分子が励起され蛍光を放射します.その光は対物レンズを通ってダイクロイックミラーを透過し,吸収フィルター(Barrier Filter2)で必要な光だけ選択されます.透過した蛍光像はリレーレンズ(Relay lens)を介して高感度カメラ(High-sensitive Camara)で結像されます.一般的に蛍光像はとても弱い光(量が少ない)であるため量子効率の高いカメラや,積算や倍増機能を有するカメラが使用されます.カメラから出力されたビデオ信号をタイムカウンター(Time Counter)を通すことでその画像信号に正確に時間を刻みます.その信号をビデオレコーダー(VCR)で記録しながら,モニター(Monitor)に映し観察します.または,コンピューター(Computer)のメモリにビデオ取り込みボード(Image Grabber Unit)を介してデジタルデータとして記録します.この映像は最大640×480ピクセル,時間間隔1/30秒で記録されます.このデータから試料の形状や運動を計測することができます.(2000年時)
5. 実験の流れ
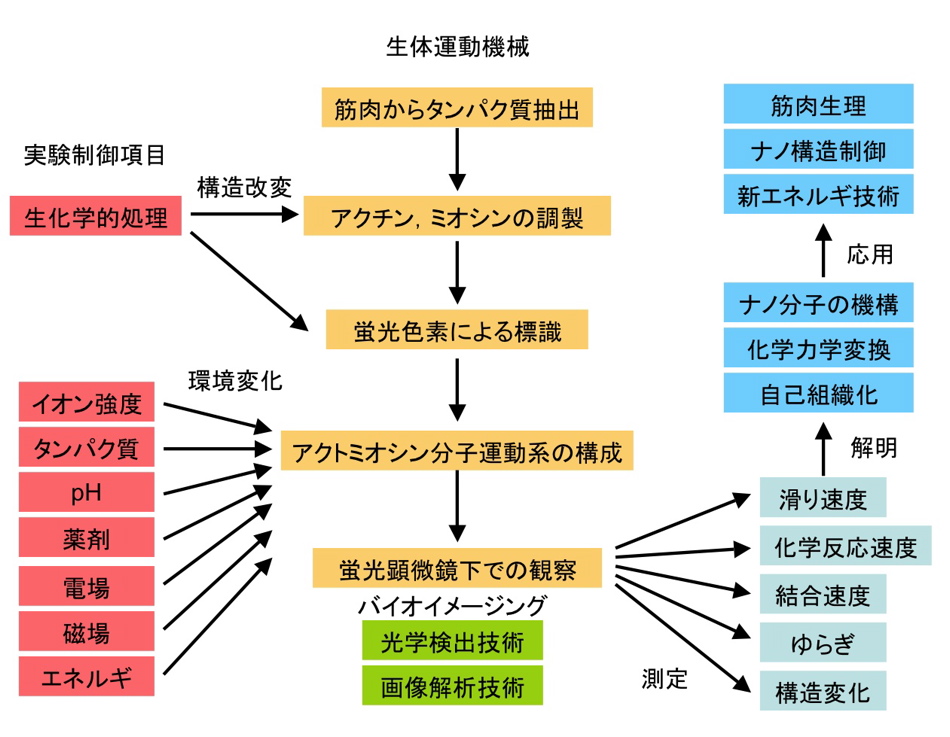
6. In vitro motility assay
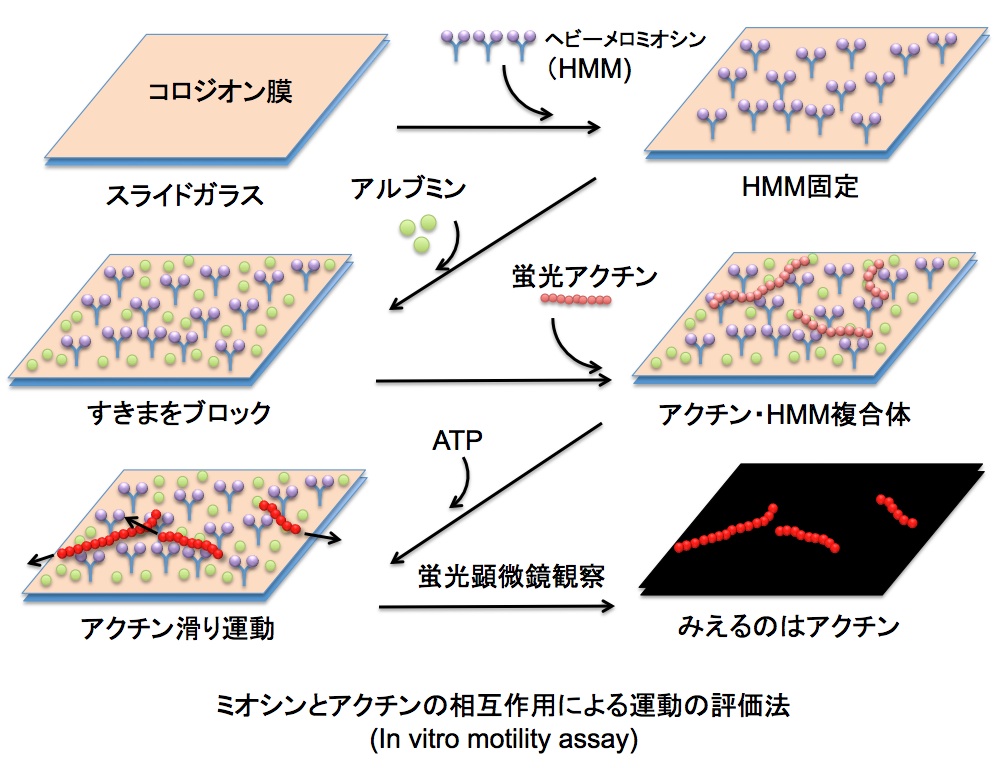
7. アクチンフィラメントの滑り運動計測
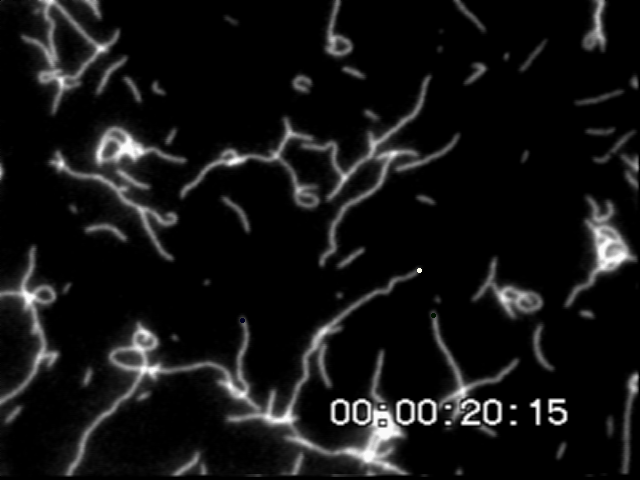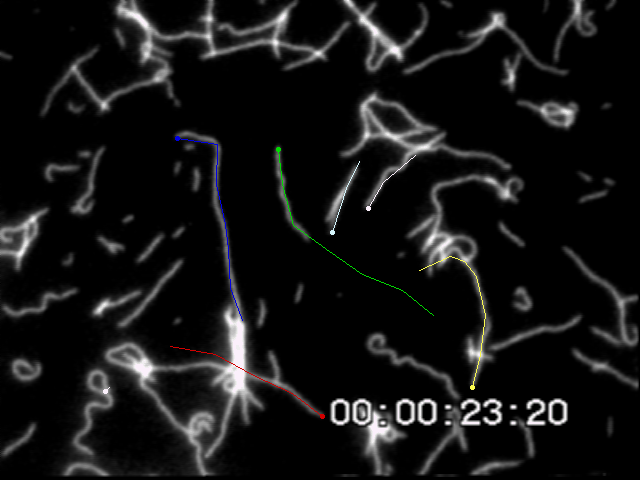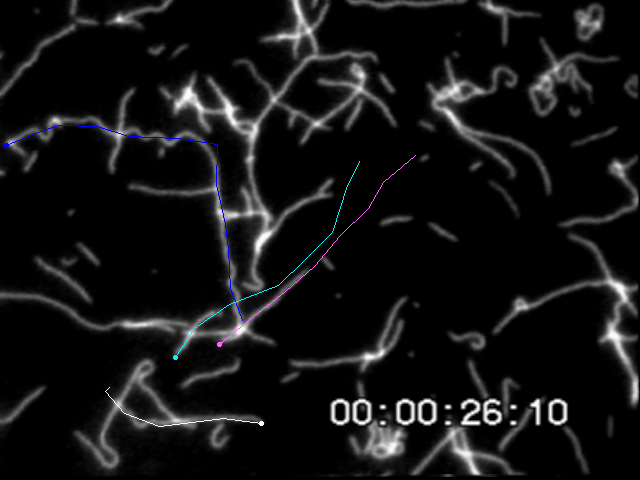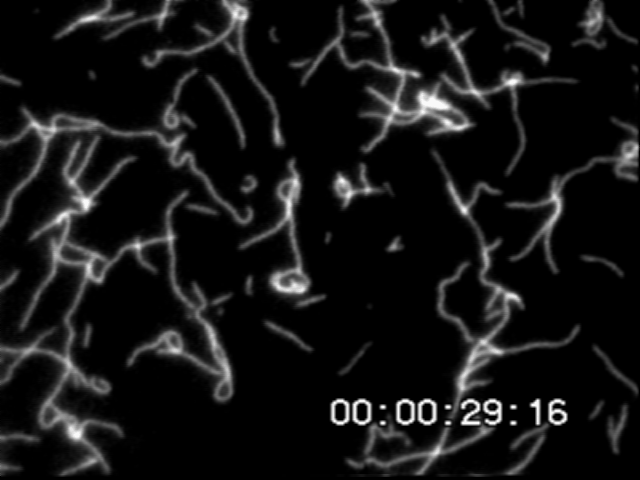
一定時間間隔でアクチンフィラメント先端の座標を取得し移動変位から速度を求める.この滑り速度はフィラメント長に依存しない.
8. 甦れ!Nikon Diaphot
超解像顕微鏡への道

ニコンDiaphotは1980年代に発売された多用途倒立顕微鏡である.有限系対物レンズ仕様で最近の無限遠系レンズ仕様のニコン顕微鏡(2000年以降)とは互換性がない.その当時,蛍光標識アクチン線維を撮影するには高価な高感度カメラ等が必要であった.しかし現在では民生用カメラも高性能低価格が進み,それを利用することで観察の敷居は大きく下がった.このDiaphotoをローダミン蛍光標識アクチン線維の観察に特化した仕様に組み替えた.駆動系のグリスが経年劣化のため固着ぎみだったため粗動ハンドルを分解し洗浄し,顕微鏡用グリス(杉浦研究所S-40N)を塗り直した結果,滑らかな動作に回復した.

観察の要は対物レンズであり,より開口数の大きな明るいレンズが適している.開口数1.4の油浸100倍の対物レンズ,Nikon Plan Apo 100 1.40 Oil 160/0.17,を入手した.光源はニコン純正の100 Wの水銀ランプとした.光路へはND2のフィルタを入れ,試料の退色を軽減させるため減光させた.蛍光フィルターにはニコン純正のローダミン用G-2A(EX510-560, DM 580, BA 590)を用いた.予算が許せば,さらに高性能フィルターに変更することもあり得る.カメラポートへの切り替えではカメラ側80%,接眼レンズ20%の仕様のため,接着されたプリズムを思い切って取り外し,カメラ側100%とした.接眼レンズへの切替時に画像の確認用として22.5度の角度でミラーを取り付けた.

カメラ素子の小型に合わせるため1倍リレーレンズ(Nikon TV relay lens 1X/16)を挿入した.カメラとリレーレンズの間にCマウント電動シャッター(エドモンド)を取り付けた.カメラにはDMK33UX287(The imaging source)を用いた.カメラのセンサーはソニーCMOS IMX287,サイズ1/2.9",画素720x540であり,高感度が期待された.その一方で赤外付近にも高い感度があるため背景光が増加した.カメラセンサー前部にIRカットフィルター(650 nm)を装着させた.

ゲージド化合物を用いた実験に対応させるため,励起用UV-LEDを取り付けた.コンデンサーの固定調整具に照射用レンズを固定させた.UV-LEDは波長365 nm(ソーラボ M365FP1)で光ファイバー(直径200 um,NA 0.22)先端でおよそ4mWであった.集光レンズで0.4倍,80 umの照射範囲とした.照射はマイコン(Arduino nano every)によりTTL 5Vで制御した.ボタンを押すことで電動シャッタが閉じ,設定時間照射の後にシャッタが開く仕様とした.

甦れ!ニコンDiaphotで撮影されたMotility Assay(30 fps)
甦れ!ニコンDiaphotで撮影されたブラウン運動するアクチン線維(20 fps)
9. 蛍光標識アクチン線維運動解析ソフト,ActinerNEO
アクチン線維の蛍光画像(Multi-TIFF形式ファイル)から運動を解析するソフトウェアである.Motility assayでのアクチン線維の滑り速度や線維長などを半自動で計算できる.
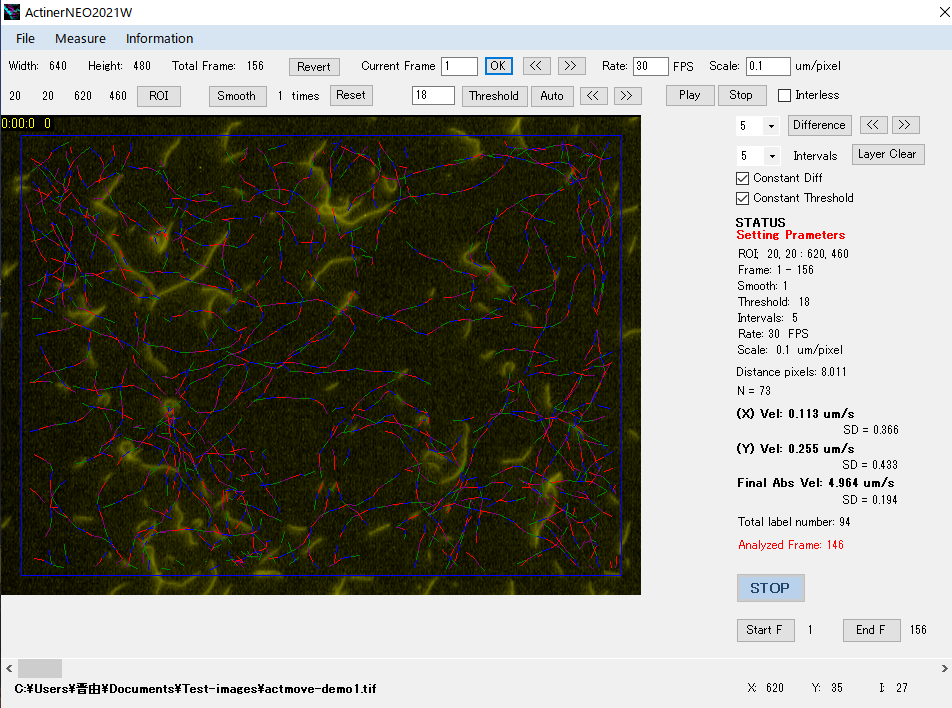
アクチン線維の滑り速度の計算結果
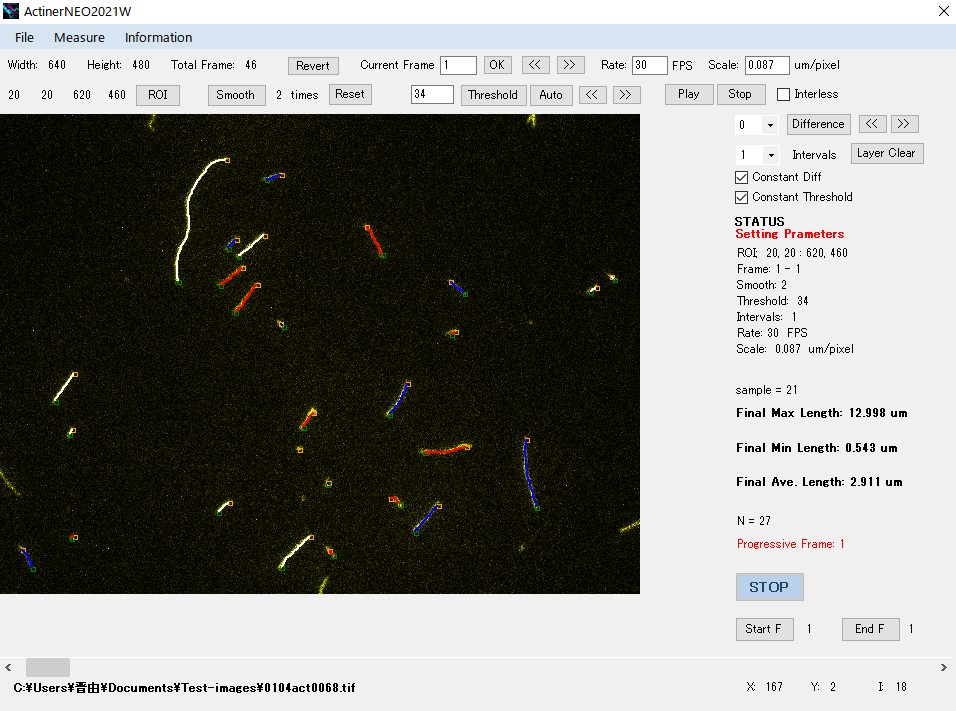
アクチン線維長の計測結果
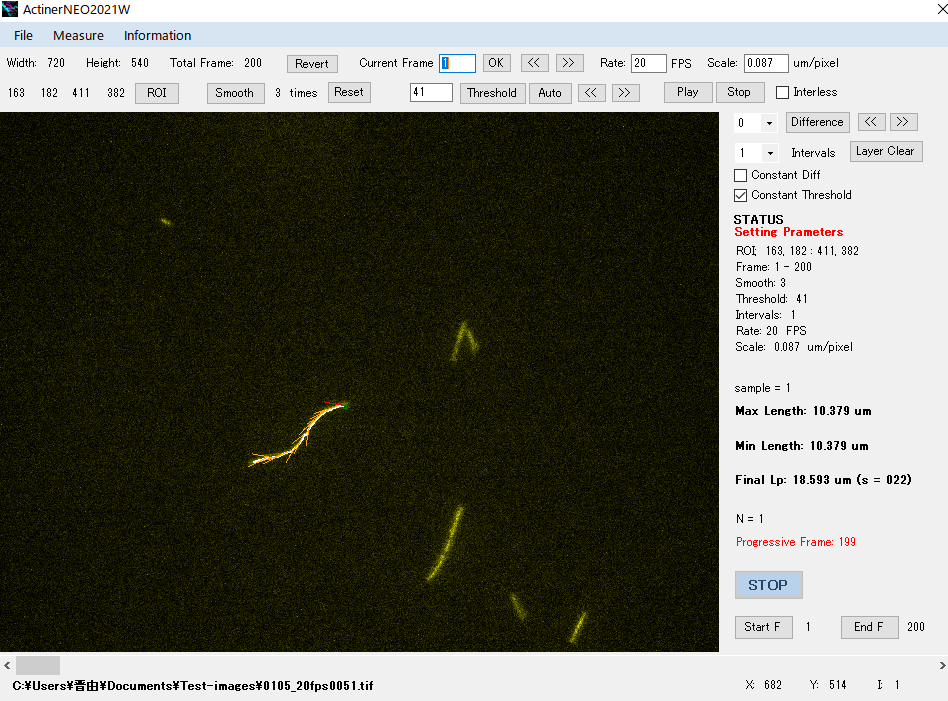
アクチン線維の持続長(曲げ剛性に関係)の計測結果
(ホームへ戻る)